Étude Liu et al. 202114
Méthodologie
Objectifs de l’étude
Démontrer la non infériorité de GADOVIST® à une dose réduite de 0,075 mmol/kg de masse corporelle versus le gadotérate de méglumine à sa dose standard de 0,1 mmol/kg de masse corporelle, chez des patients adressés pour IRM cérébrale avec rehaussement.
Méthodologie de l’étude
Étude de phase IV, prospective, internationale, multicentrique, en ouvert avec administration croisée de 2 produits de contraste.
Administration
- Délai entre les 2 injections : 24 heures à 15 jours
- Injection en IV à un débit de 2 ml/s suivie par 20 ml d’une solution saline à 0,9 % au même débit à l’aide d’un injecteur.
Protocole IRM
- IRM à 1,5 T et 3 T avec antenne standard dédiée
- Protocole standard identique pour les 2 IRM de chaque patient
- Avant injection de gadolinium :
- Séquence SE rapide T2w (coupe sagittale ou axiale)
- Séquence SE rapide T1w (coupe axiale)
- Séquence FLAIR (coupe axiale)
- 4 à 10 minutes près injection de gadolinium :
- Séquence SE rapide T1w (coupe axiale ou frontale)
FLAIR : Fluid Attenuated Inversion Recovery (séquence utilisée pour l’imagerie cérébrale ou séquence d’inversion-récupération)
IRM : Imagerie par résonance magnétique
SE : Spin echo
Critères d’inclusion
- > 18 ans présentant des lésions cérébrales connues ou suspectées prenant le contraste
- Adressés pour IRM cérébrale avec injection de produit de contraste entre novembre 2018 et mars 2020
Critères d’exclusion
- Contre-indications à l’IRM ou à l’administration de produit de contraste (PdC) gadoliné
- DFGe > 60 ml/min/1,73 m2 mesuré dans les 4 semaines précédent la 1ère IRM
- Grossesse
Objectifs primaires
- Démontrer la non-infériorité de GADOVIST® à une dose réduite de 0,075 mmol/kg vs gadotérate de méglumine à 0,1 mmol/kg en IRM sur 3 paramètres* :
- Degré de rehaussement de contraste de la lésion
- Délimitation de la bordure de la lésion
- Morphologie interne de la lésion
*La non infériorité était vérifiée si la dose réduite de GADOVIST® 0,075 mmol/kg permettait de préserver au moins 80 % de l’amélioration obtenue par l’injection du gadotérate par rapport à l’IRM non réhaussée et ce sur la base de la moyenne de l’analyse des 3 lecteurs.
Objectifs secondaires
- Démontrer la non-infériorité de GADOVIST® à une dose réduite de 0,075 mmol/kg vs gadotérate de méglumine à 0,1 mmol/kg en IRM sur 4 paramètres :
- Nombre total de lésions basé sur une lecture en aveugle
- Détection des lésions SNC malignes (spécificité, sensibilité, précision) basée sur une lecture en aveugle
- Confiance diagnostique des lecteurs
- Préférence du lecteur par comparaison en aveugle par paires (images T1w uniquement)
SNC : Système Nerveux Central
Évaluation des images IRM
- Relecture centralisée en aveugle par 3 lecteurs expérimentés en neuroradiologie.
- Les lecteurs effectuaient l’ensemble de leur analyse sur 2 sessions séparées d’au moins 2 semaines.
- Durant chacune d’elles, les lecteurs analysaient uniquement :
- soit les images pré- et post-contraste de gadobutrol à une dose réduite de 0,075 mmol/kg.
- soit les images pré- et post-contraste de gadotérate de méglumine à sa dose standard de 0,1 mmol/kg.
- Lors de chaque session, les lecteurs devaient dans un 1er temps examiner et attribuer un score à toutes les images IRM pré-contraste puis, dans un second temps, faire une lecture conjointe des IRM pré- et post-contraste et y attribuer un score.
- Immédiatement après la seconde session, les lecteurs étaient invités à faire une comparaison directe dans une 3ème session, entre la qualité de l’image (images T1w uniquement) obtenue par gadobutrol et celle obtenue par gadotérate de méglumine pour chaque patient.
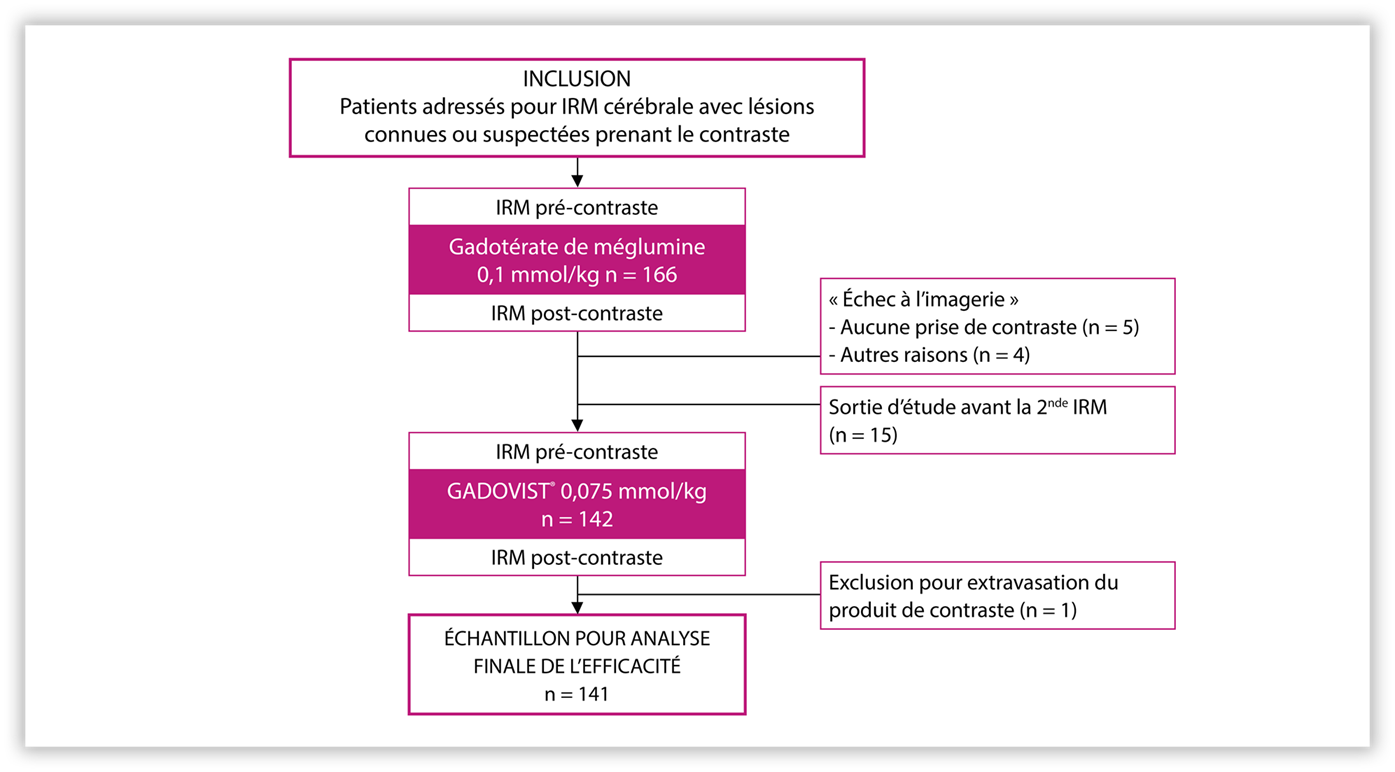
Population étudiée (N = 141)

Résultats des critères principaux
Résultat du test de non-infériorité (population FAS, n = 141) :
Le gadobutrol à une dose réduite de 0,075 mmol/kg démontre une efficacité similaire au gadotérate de méglumine à sa dose standard de 0,1 mmol/kg sur le réhaussement de contraste.
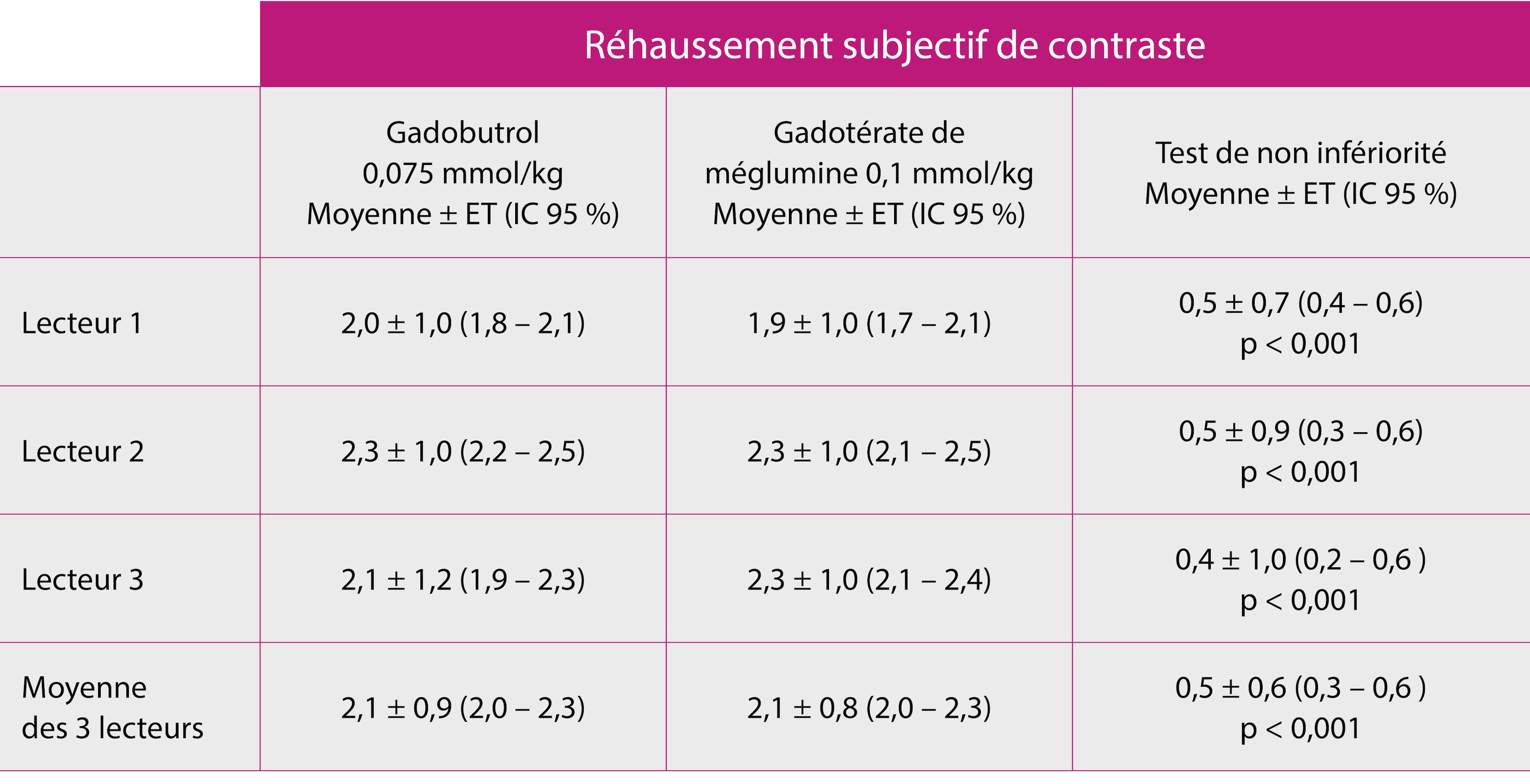
La non infériorité était vérifiée si la dose réduite de GADOVIST® 0,075 mmol/kg permettait de préserver au moins 80 % de l’amélioration obtenue par l’injection du gadotérate par rapport à l’IRM non réhaussée et ce sur la base de la moyenne de l’analyse des 3 lecteurs.
ET = écart type ; FAS = full analysis set ; IC = intervalle de confiance
Résultat du test de non-infériorité (population FAS, n = 141) :
Le gadobutrol à une dose réduite de 0,075 mmol/kg démontre une efficacité similaire au gadotérate de méglumine à sa dose standard de 0,1 mmol/kg sur la délimitation de la bordure de la lésion.
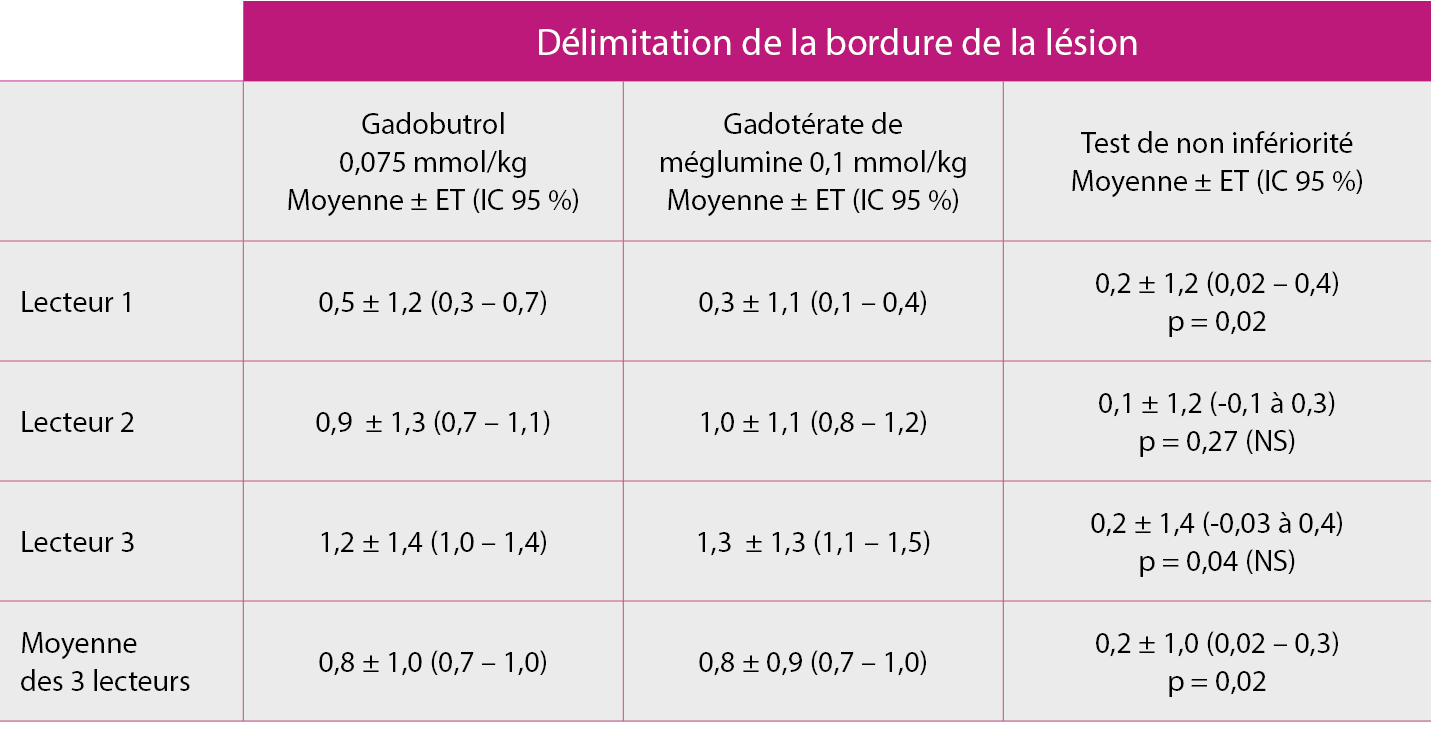
La non infériorité était vérifiée si la dose réduite de GADOVIST® 0,075 mmol/kg permettait de préserver au moins 80 % de l’amélioration obtenue par l’injection du gadotérate par rapport à l’IRM non réhaussée et ce sur la base de la moyenne de l’analyse des 3 lecteurs.
ET = écart type ; FAS = full analysis set ; IC = intervalle de confiance
Résultat du test de non-infériorité (population FAS, n = 141) :
Le gadobutrol à une dose réduite de 0,075 mmol/kg démontre une efficacité similaire au gadotérate de méglumine à sa dose standard de 0,1 mmol/kg sur la morphologie interne de la lésion.
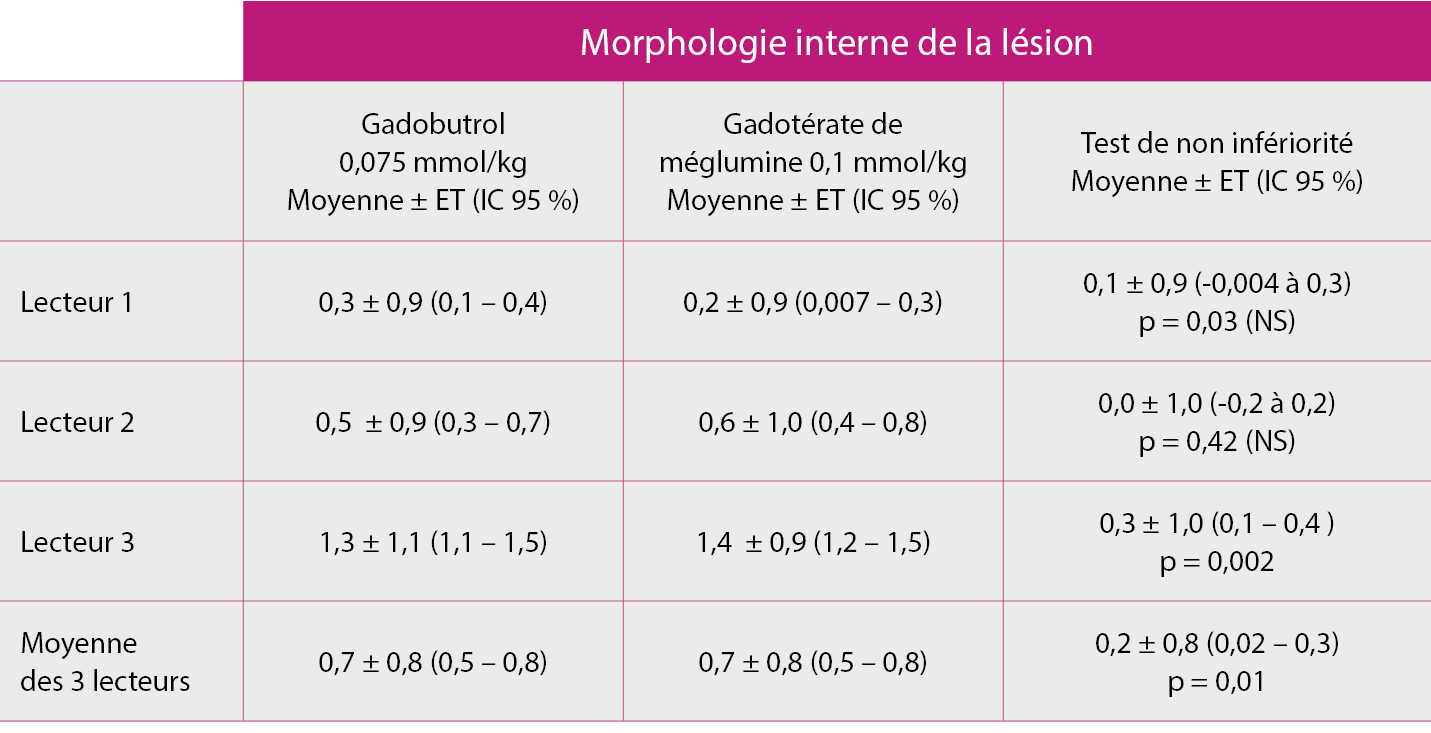
La non infériorité était vérifiée si la dose réduite de GADOVIST® 0,075 mmol/kg permettait de préserver au moins 80 % de l’amélioration obtenue par l’injection du gadotérate par rapport à l’IRM non réhaussée et ce sur la base de la moyenne de l’analyse des 3 lecteurs.
ET = écart type ; FAS = full analysis set ; IC = intervalle de confiance
Résultats des critères secondaires
Résultat du test de non-infériorité (population FAS, n = 141) :
Le nombre moyen de lésions détectées avec injection de gadobutrol à une dose réduite de 0,075 mmol/kg est comparable à celui obtenu avec le gadotérate de méglumine à sa dose standard de 0,1 mmol/kg.
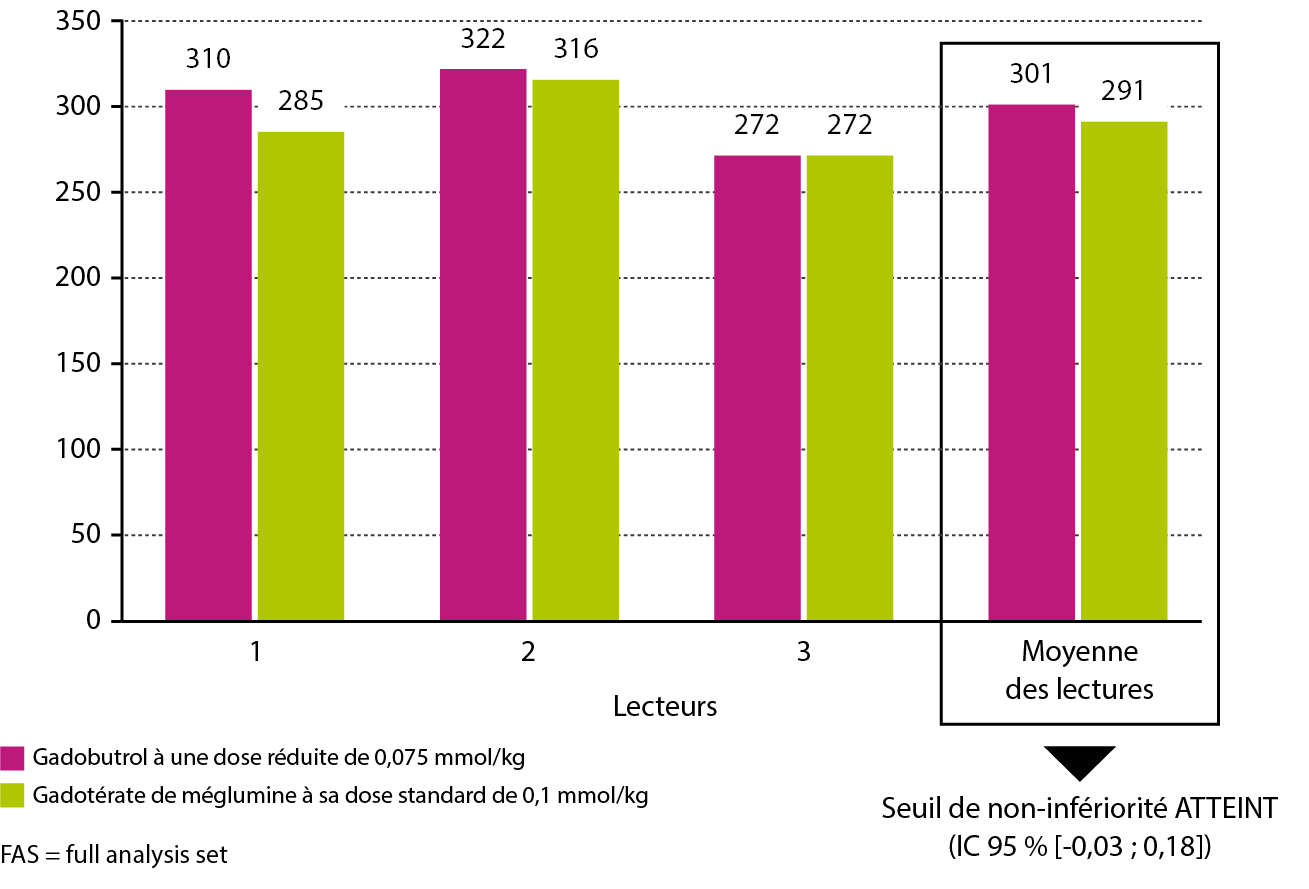
Résultat du test de non-infériorité (population FAS, n = 141) :
Le score de confiance diagnostique obtenu avec l’injection de gadobutrol à une dose réduite de 0,075 mmol/kg est comparable à celui obtenu avec le gadotérate de méglumine à sa dose standard de 0,1 mmol/kg.
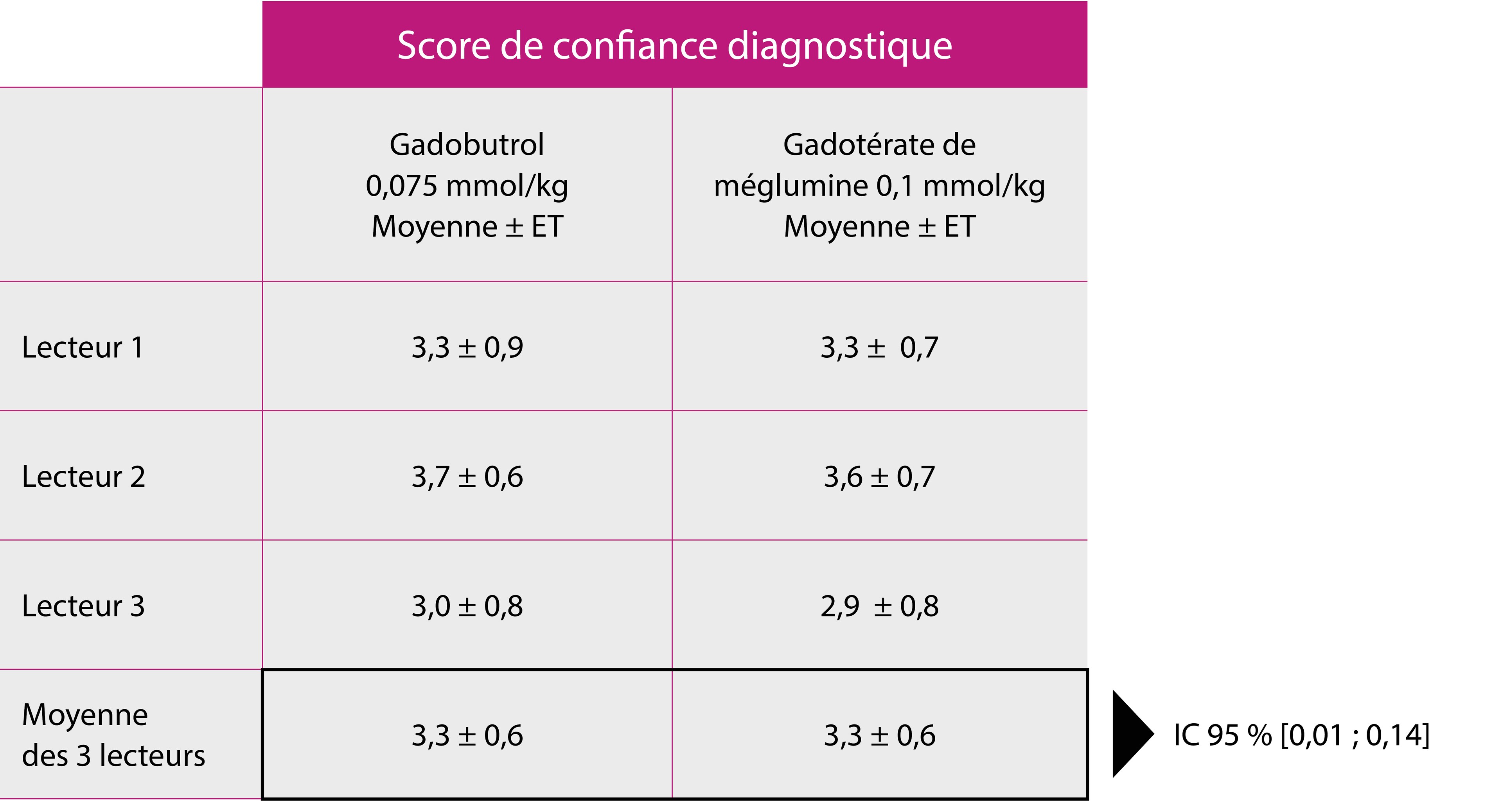
ET = écart type ; FAS = full analysis set ; IC = intervalle de confiance
Résultat du test de non-infériorité (population FAS, n = 141) :
La sensibilité, la spécificité et la précision en termes de détection des lésions malignes du SNC étaient similaires, quel que soit le produit de contraste injecté.

Les valeurs sont présentées sous forme de pourcentage des données brutes (n patients / n total patients)
* Définie comme l’évaluation d’au moins 2 ou 3 des lecteurs
FAS = full analysis set ; IC = intervalle de confiance ; SNC : Système Nerveux Central
Résultat du test de non-infériorité (population FAS, n = 141) :
En termes de préférence, la réponse la plus communément rapportée par les lecteurs était l’absence de préférence pour l’un ou l’autre des produits de contraste (aucune différence significative, IC 95 % [-0,10 ; 0,11] ).

FAS = full analysis set ; IC = intervalle de confiance.
Tolérance
- Aucun décès, ou effets indésirables graves d’origine indéterminée ou associés au traitement, n’a été documenté pour aucun des patients durant l’étude.
- 3 effets indésirables d’intensité modérée ont été documentés :
- 1 effet indésirable dans le groupe gadobutrol à une dose réduite de 0,075 mmol/kg (parasthésie)
- 2 effets indésirables dans le groupe gadoterate de méglumine à sa dose standard de 0,1 mmol/kg (prurit, urticaire)
GADOVIST® ne doit être utilisé que lorsque le diagnostic est nécessaire et que ce diagnostic ne peut être obtenu par IRM sans rehaussement de contraste.
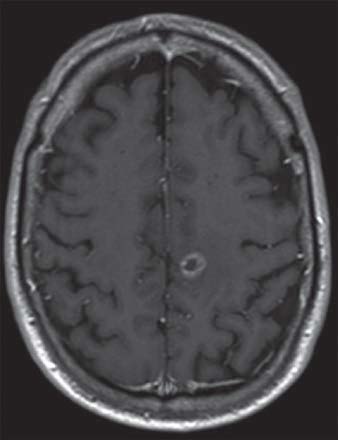
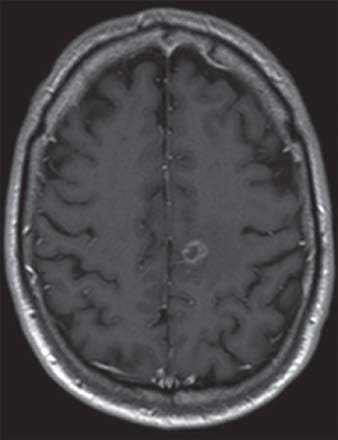
Études de cas
IRM d’un homme de 61 ans présentant des métastases dans l’hémisphère gauche du cerveau secondaire à un cancer du poumon
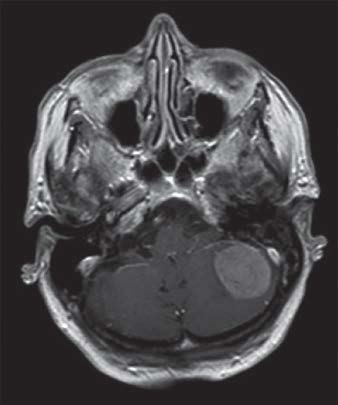
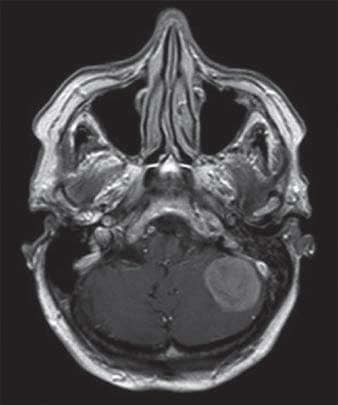
IRM d’une femme de 88 ans atteinte d’un méningiome de la fosse cérébrale postérieure
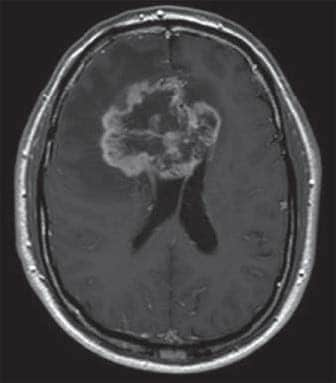
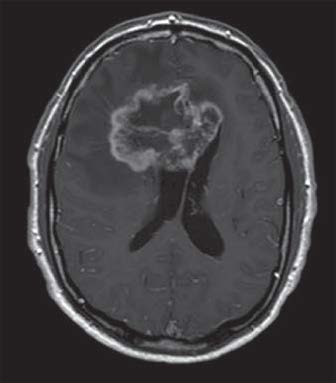
IRM d’un homme de 64 ans atteint d’un glioblastome
Bibliographie
- 14. Liu BP, et al. Clinical Efficacy of Reduced-Dose Gadobutrol Versus Standard-Dose Gadoterate for Contrast-Enhanced MRI of the CNS: An International Multicenter Prospective Crossover Trial (LEADER-75). AJR Am J Roentgenol. 2021;217(5):1195-1205. Return to content
- 19. Avis de la Commission de Transparence de GADOVIST® du 25/07/2018 et du 13/03/2024. Return to content